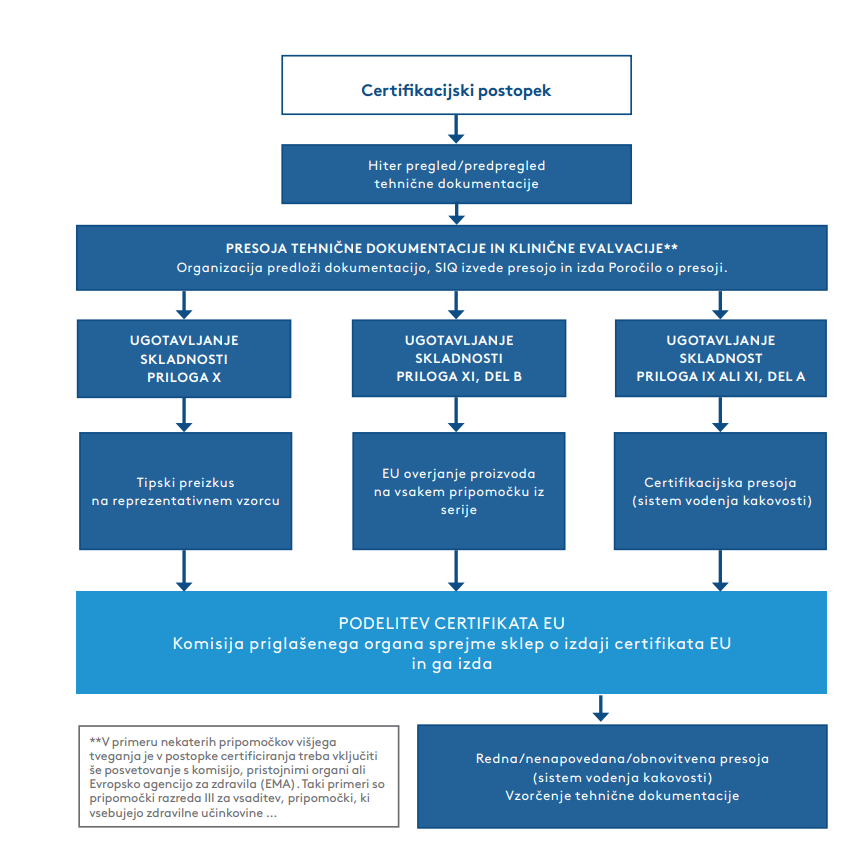
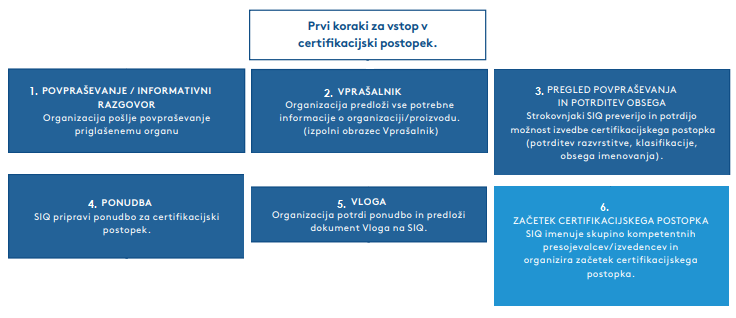
Certifikacijski postopek po Uredbi (EU) 2017/745
Prvi del postopka predstavlja presoja tehnične dokumentacije in klinične evalvacije proizvoda. Ko je presoja tehnične dokumentacije in klinične evalvacije zaključena in je dokumentacija v skladu z uredbo MDR, sledi nadaljevanje certifikacijskega postopka, in sicer glede na izbran postopek ugotavljanja skladnosti. Najpogosteje se proizvajalci odločajo za postopek ugotavljanja skladnosti po Prilogi IX ali Prilogi XI, del A, ki vključuje presojanje vzpostavljenega sistema vodenja kakovosti. V takih primerih se certifikacijski postopek nadaljuje s certifikacijsko presojo. Presoja se lahko kombinira s presojo po standardu ISO 13485:2016. EU certifikat je veljaven za obdobje 5 let. Enkrat letno, z rednimi presojami preverjamo delovanje sistema kakovosti.