Medicinski pripomočki – bs
Direktiva 93/42/EGS o medicinskih pripomočkih
Direktiva 93/42/EGS
Direktiva 93/42/EGS o medicinskih pripomočkih ureja področje medicinskih pripomočkov za humano uporabo in vključuje neaktivne medicinske pripomočke, neaktivne vsadke, pripomočke za oskrbo ran, neaktivne zobne pripomočke, medicinske pripomočke vezane na vir napetosti/aktivne medicinske pripomočke, medicinske pripomočke za slikovno diagnostiko in terapijo, medicinske pripomočke za nadzorovanje/monitoring, medicinske pripomočke za radio/termoterapijo, sterilne medicinske pripomočke … Obseg imenovanja – Priglašeni organ SIQ (NB No.1304)
Zakaj pridobiti certifikat
Zakonodaja EU (Direktiva 93/42/EGS) o medicinskih pripomočkih in pripadajoča slovenska zakonodaja v zvezi z medicinskimi pripomočki določa, da morajo proizvajalci medicinskih pripomočkov svoje proizvode označiti s CE oznako, preden jih ponudijo na trg EU. S tem izjavljajo, da je medicinski pripomoček skladen s predpisi slovenske zakonodaje in predpisi EU, ki urejajo področje medicinskih pripomočkov ter zagotavljajo, da je njihov medicinski pripomoček varen in strokovno ustrezen. Kadar je medicinski pripomoček razreda Is, Im, IIa, IIb in III, je potrebno v postopek ugotavljanja skladnosti medicinskega pripomočka vključiti tudi priglašeni organ (SIQ). Skladnost z zahtevami predpisov EU, ki urejajo medicinske pripomočke, ter slovenske zakonodaje, se izkazuje s podeljenim ES certifikatom (EC Certificate).
Sistem vodenja kakovosti po ISO 13485 in direktiva 93/42/EGS
ISO 13485 je harmonizirani standard s katerim proizvajalci medicinskih pripomočkov dokazujejo usklajenost sistema kakovosti skladno z zahtevami direktive 93/42/EGS, poleg zahtev standarda pa morajo proizvajalci vključiti tudi posebne zahteve, ki jih določa direktiva. Pri postopkih ocenjevanja skladnosti po Aneksu II, V in VI, priporočamo, da ima proizvajalec že vzpostavljen sistem kakovosti po standardu ISO 13485.
Certifikacija medicinskih pripomočkov po direktivi 93/42/EGS
Medicinski pripomočki se lahko ponudijo na trg EU in nosijo oznako CE, če izpolnjujejo bistvene zahteve direktive 93/42/EGS o medicinskih pripomočkih, na trgu Republike Slovenije pa morajo izpolnjevati tudi zahteve Zakona o medicinskih pripomočkih in njegovih podzakonskih aktov. Medicinski pripomočki se glede na stopnjo tveganja razvrščajo v:
- razred I – medicinski pripomočki z nizko stopnjo tveganja za uporabnika,
- razred IIa– medicinski pripomočki z večjo stopnjo tveganja za uporabnika,
- razred IIb– medicinski pripomočki z visoko stopnjo tveganja za uporabnika in
- razred III– medicinski pripomočki z najvišjo stopnjo tveganja za uporabnika.
Postopek certifikacije sestavljata presoja dokumentacije/tehnične mape medicinskega pripomočka in certifikacijska presoja. Priporočeno je, da ima proizvajalec medicinskih pripomočkov vzpostavljen sistem kakovosti po standardu ISO 13485. Presoja po medicinski direktivi se lahko kombinira s presojo po standardu ISO 13485. Po podelitvi ES certifikata in certifikata po ISO 13485 enkrat letno, z rednimi presojami v posameznih delih sistema, preverjamo delovanje sistema, enkrat v treh letih pa izvedemo obnovitveno presojo. ES certifikat je veljaven, dokler z vsakoletnimi presojami dokazujete, da izpolnjujete zahteve Direktive 93/42/EGS.
Postopki ocenjevanja skladnosti
Postopek ocenjevanja skladnosti medicinskega pripomočka je odvisen od klasifikacije medicinskega pripomočka/razreda in s tem povezane stopnje tveganja za uporabnika ter odločitve proizvajalca. Večina proizvajalcev se odloči za postopek ocenjevanja skladnosti po Aneksu V ali Aneksu II. Postopki ocenjevanja skladnosti medicinskih pripomočkov: 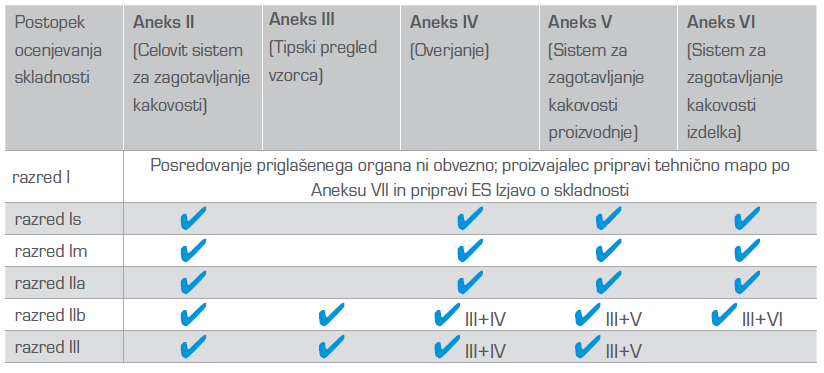
Glavni koraki v postopku pridobitve CE oznake
- Klasifikacija medicinskega pripomočka
- Vzpostavitev kontakta s priglašenim organom za medicinske pripomočke razreda Is, Im, IIa, IIb in III
- Izbira ustreznega postopka ocenjevanja skladnosti
- Odločitev za vzpostavitev sistema kakovosti po ISO 13485 za proizvajalce medicinskih pripomočkov razreda Is, Im, IIa, IIb in III (z izjemo postopka ocenjevanja skladnosti po aneksu III in IV)
- Izpolnjevanje bistvenih zahtev direktive
- Priprava tehnične mape z ES izjavo o skladnosti
- Ocenjevanje skladnosti
- Pritrditev CE oznake na medicinske pripomočke
Tehnična dokumentacija/Tehnična mapa
Proizvajalec mora v postopku ocenjevanja skladnosti pripraviti tehnično mapo za medicinski pripomoček/skupino medicinskih pripomočkov, po kateri se preverja izpolnjevanje bistvenih zahtev medicinske direktive. Obvezna vsebina tehnične mape je opredeljena v smernici NBOG’s BPG 2009-1. Tehnično mapo ocenjuje priglašeni organ, razen v primeru medicinskih pripomočkov razreda I, ko to ni obvezno.
Preizkušanje električne in magnetne varnosti za aktivne medicinske pripomočke
Proizvajalci aktivnih medicinskih pripomočkov morajo v postopku ocenjevanja skladnosti dokazovati tudi izpolnjevanje bistvenih zahtev na področju električne in magnetne varnosti. SIQ nudi priznane in akreditirane preskusne laboratorije za preskušanje nekaterih vrst električnih medicinskih pripomočkov in opreme ter ugotavljanje elektromagnetne združljivosti.
Kontakt

- SIQ Ljubljana
- Tržaška cesta 2
- SI-1000 Ljubljana
- Vesna Rems Odar
- Tel: (01) 4778 159
- vesna.rems@siq.si
Povezave
Zakon o medicinskih pripomočkih (MP)
Pravilnik o medicinskih pripomočkih
Evropska vodila po zakonodaji v zvezi z medicinskimi pripomočki
Postopek certificiranja medicinskih pripomočkov
Vprašalnik za certificiranje medicinskih pripomočkov po direktivi 93/42/EEC
Javna agencija RS za zdravila in medicinske pripomočke