Präsentation
EU-Verordnung 2017/745 zu Medizinprodukten
EU-Verordnung 2017/745
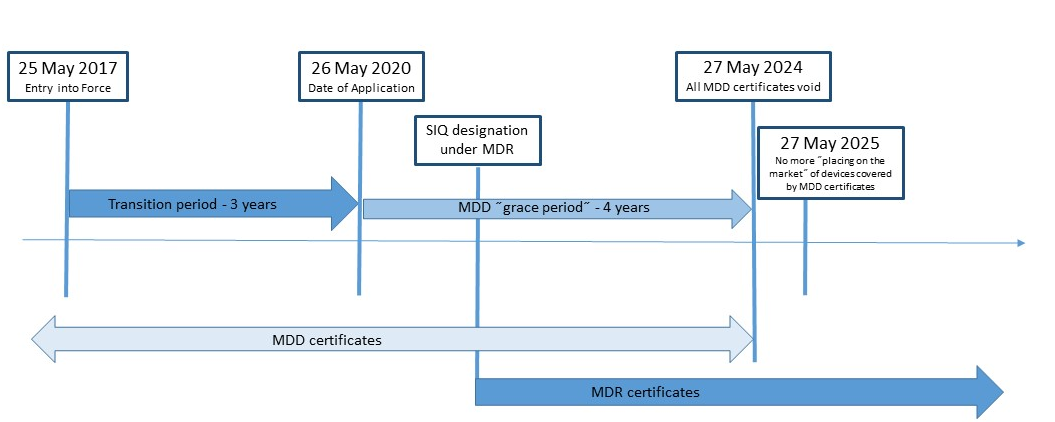
Die neue EU-Verordnung für Medizinprodukte 2017/745 (MDR) wurde am 5. Mai 2017 im Amtsblatt der Europäischen Union veröffentlicht und trat am 25. Mai 2017 in Kraft. Die MDR Verordnung wird die Richtlinie zu Medizinprodukten (MDD) 93/42/EWG und die Richtlinie über aktiv implantierbaren Medizinprodukten (AIMD) 90/385/EWG ersetzen. SIQ Ljubljana nimmt derzeit im Berufungsprozess gemäß der Verordnung (EU) 2017/745 teil. Nach der Veröffentlichung des MDR (25. Mai 2017) gemäß dem MDD, behalten ausgestellte Zertifikate ihre Gültigkeit bis zum Ende des auf dem Zertifikat angegebenen Zeitraums, der nicht länger als fünf Jahre ab dem Ausstellungsdatum sein soll. Sie werden jedoch spätestens am 27. Mai 2024 ungültig.
Warum brauchen Sie ein Zertifikat?
Die EU-Gesetzgebung (MDD-Verordnung) zu Medizinprodukten sieht vor, dass Hersteller von Medizinprodukten ihre Produkte mit der CE-Kennzeichnung versehen müssen, bevor sie in der EU in Verkehr gebracht werden. Dadurch erklären sie, dass das Medizinprodukt den EU-Vorschriften für Medizinprodukte entspricht, und stellen sicher, dass das Medizinprodukt sicher und technisch geeignet ist. Handelt es sich bei einem Medizinprodukt um ein Medizinprodukt der Klassen Is, Im, Ir, IIa, IIb und III (MDR), dann muss die zuständige Behörde (SIQ) ebenfalls in das Konformitätsbewertungsverfahren des Medizinprodukts einbezogen werden. Die Einhaltung der Anforderungen der EU-Vorschriften für Medizinprodukte wird durch ein EU-Zertifikat nachgewiesen.
Qualitätsmanagementsystem nach ISO 13485 und EU-Verordnung 2017/745
ISO 13485 ist eine harmonisierte Norm, mit der ein Hersteller von Medizinprodukten nachweist, dass das Qualitätssicherungssystem den Anforderungen der MDR-Verordnung entspricht. Zusätzlich zu den Anforderungen der Norm müssen die Hersteller auch die in der Verordnung festgelegten spezifischen Anforderungen einbeziehen. Für die Konformitätsbewertungsverfahren nach Anhang IX und Anhang XI Teil A wird empfohlen, dass der Hersteller bereits über ein Qualitätssicherungssystem nach ISO 13485 verfügt.
Zertifizierung von Medizinprodukten gemäß der EU-Verordnung 2017/745
Medizinprodukte dürfen in der EU in Verkehr gebracht werden und die CE-Kennzeichnung tragen, wenn sie den wesentlichen Anforderungen der Verordnung (MDR) entsprechen. Medizinprodukte werden nach ihrem Risikograd in die folgenden Gruppen eingeteilt:
- Klasse I – Medizinprodukte mit geringem Risiko für den Anwender;
- Klasse IIa – Medizinprodukte mit höherem Risiko für den Benutzer;
- Klasse IIb – Medizinprodukte, die ein hohes Risiko für den Anwender bedeuten und
- Klasse III – Medizinprodukte mit dem höchsten Risiko für den Benutzer.
Der Zertifizierungsprozess besteht aus einem Audit der Medizinproduktedokumentation/der technischen Unterlagen und einer Zertifizierungsbeurteilung. Es wird empfohlen, dass der Hersteller des Medizinprodukts über ein Qualitätssicherungssystem gemäß ISO 13485 verfügt. Die Beurteilung der medizinischen Vorschriften kann mit der Norm ISO 13485 kombiniert werden. Nach Erteilung des EU-Zertifikats und des Zertifikats nach ISO 13485 wird das System einmal jährlich mit regelmäßigen Audits von einzelnen Teilen des Systems überprüft und alle drei Jahre wird ein Erneuerungsaudit durchgeführt. Ein EU-Zertifikat ist gültig, solange Sie jährlich nachweisen, dass Sie die Anforderungen der ISO 13485 erfüllen.
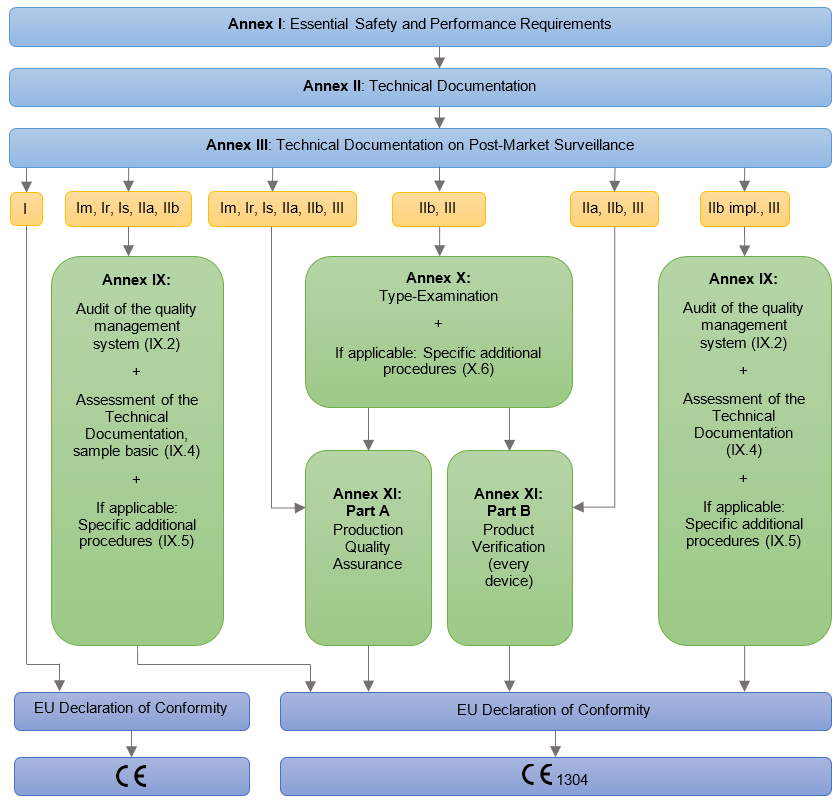
Die wichtigsten Schritte zur Erteilung der CE-Kennzeichnung
- Klassifizierung von Medizinprodukten;
- Kontaktaufnahme mit der zuständigen Behörde für Medizinprodukte der Klassen Is,
- Im, Ir, IIa, IIb und III;
- Auswahl des geeigneten Konformitätsbewertungsverfahrens (abhängig von der Klassifikation des Medizinprodukts/der Klasse und dem damit verbundenen Risikograd für den Benutzer und der Entscheidung des Herstellers);
- Beschluss zur Einrichtung eines ISO 13485 Qualitätssystems für die Hersteller von Medizinprodukten der Klassen Is, Im, Ir, IIa, IIb und III (mit Ausnahme des Konformitätsbewertungsverfahrens in Anhang IX und XI, Teil A);
- Erfüllung von wesentlichen Anforderungen der MDR-Verordnung;
- Erstellung der technischen Unterlagen einschließlich EG-Konformitätserklärung (Anhang IV MDR);
- Konformitätsbewertung;
- Anbringung der CE-Kennzeichnung an den Medizinprodukten.
Technische Dokumentation/Technische Unterlagen
Der Hersteller muss während des Konformitätsbewertungsverfahrens technische Unterlagen für das Medizinprodukt/die Medizinproduktegruppe erstellen, wo die Einhaltung der grundlegenden Anforderungen der Medizinverordnung nachgewiesen wird. Der verbindliche Inhalt der technischen Unterlagen wird in Anhang II und Anhang III der MDR-Verordnung festgelegt. Die technischen Unterlagen werden von der zuständigen Behörde bewertet. Das gilt nicht für Medizinprodukte der Klasse I, wo dies nicht vorgeschrieben ist.
Elektrische und magnetische Sicherheitsprüfung für aktive Medizinprodukte
Hersteller von aktiven Medizinprodukten müssen im Konformitätsbewertungsverfahren auch die Einhaltung der grundlegenden Anforderungen an die elektrische und magnetische Sicherheit nachweisen. SIQ bietet anerkannte und akkreditierte Prüflabors an, um bestimmte Arten von medizinischen Elektrogeräten und Geräten zu testen und die elektromagnetische Verträglichkeit zu bestimmen.
Kontakt
- SIQ Ljubljana
- Mašera – Spasićeva ulica 10
- SI-1000 Ljubljana
- Vesna Rems Odar
- Tel: (01) 4778 159
- vesna.rems@siq.si
Povezave
Medical Devices Act (Official Gazette of the Republic of Slovenia)
Rules on medical devices (Official Gazette of the Republic of Slovenia)
European Guidance to Assist Stakeholders in Implementing Directives Related to Medical Devices
Fees According to Regulation (EU) 2017/745 on Medical Devices
Agency for Medicinal Products and Medical Devices of the Republic of Slovenia
